Schwermetalle sind chemische Elemente mit einer Dichte von mehr als 5 g/cm³ und einem hohen Atomgewicht. Aufgrund ihrer spezifischen physikalischen und chemischen Eigenschaften werden sie in zahlreichen industriellen Prozessen eingesetzt. Zu den häufigsten Schwermetallen in industriellen Abwässern zählen Blei (Pb), Kupfer (Cu), Zink (Zn), Nickel (Ni), Chrom (Cr), Cadmium (Cd) und Quecksilber (Hg). Diese Metalle sind jedoch bereits in niedrigen Konzentrationen toxisch und stellen daher eine erhebliche Herausforderung für die Wasser- und Abwasserbehandlung dar.
Inhaltsverzeichnis
Industrielle Quellen von Schwermetallen
Die industrielle Nutzung von Schwermetallen führt zu deren Eintrag in Abwässer. Diese Belastung hängt stark von den jeweiligen Prozessen und der Branche ab. Schwermetalle können durch Abwässer, Spülwasser oder Produktionsreste in die Umwelt gelangen. Im Folgenden werden die wichtigsten industriellen Quellen beschrieben:
Galvanik und Oberflächenbehandlung
- Anwendung:
- Nickel, Chrom und Zink werden in der Galvanotechnik zur Beschichtung von Metallen verwendet, um Korrosionsschutz, Härte oder dekorative Eigenschaften zu erzielen.
- Schwermetalle im Abwasser:
- Typische Belastungen sind Chrom(VI), Nickel, Zink und Kupfer.
- Herausforderungen:
- Häufig enthalten Spülwässer eine Kombination aus verschiedenen Schwermetallen, die eine gezielte Abtrennung erschwert.
Metallverarbeitung
- Stahl- und Aluminiumproduktion:
- Rückstände aus der Metallverhüttung und der Bearbeitung von Metallen enthalten Schwermetalle wie Cadmium, Zink und Blei.
- Werkzeug- und Maschinenbau:
- Abwässer enthalten oft Kupfer- und Nickelkontaminationen aus Schmier- und Kühlmitteln sowie aus der Fertigungstechnik.
- Automobilindustrie:
- In der Fahrzeugproduktion, insbesondere bei Lackierungen, Beschichtungen und der Fertigung von Bauteilen, gelangen Schwermetalle wie Zink, Chrom und Kupfer ins Abwasser.
Bergbau und Erzverarbeitung
- Anwendung:
- Beim Abbau von Metallen wie Kupfer, Zink oder Blei sowie bei der Verarbeitung von Erzen entstehen Abwässer mit hohen Konzentrationen an Eisen, Mangan, Cadmium und anderen Metallen.
- Herausforderungen:
- Abwasser aus Minen ist oft sauer (sogenanntes „saurer Grubenwässer“) und enthält Schwermetalle in gelöster Form.
Chemische und petrochemische Industrie
- Anwendung:
- Schwermetalle wie Quecksilber, Nickel und Chrom werden als Katalysatoren in chemischen Reaktionen eingesetzt.
- Schwermetalle im Abwasser:
- Rückstände aus katalytischen Prozessen sowie Verunreinigungen in Rohstoffen tragen zu Schwermetallbelastungen bei.
Elektronik- und Elektroindustrie
- Anwendung:
- Schwermetalle wie Kupfer, Blei und Zinn sind essenziell für die Herstellung von Leiterplatten, Batterien und Elektronikbauteilen.
- Schwermetalle im Abwasser:
- Lötmaterialien, galvanische Prozesse und die Reinigung von Bauteilen führen zu Belastungen durch Blei, Zink, Nickel und Kupfer.
Farben-, Lack- und Pigmentindustrie
- Anwendung:
- Schwermetalle wie Chrom, Blei und Cadmium werden als Farbpigmente und Stabilisierungsmittel verwendet.
- Schwermetalle im Abwasser:
- Abwässer enthalten oft Reste aus der Produktion, die toxisch und schwer biologisch abbaubar sind.
Glas- und Keramikindustrie
- Anwendung:
- Schwermetalle wie Blei und Cadmium werden zur Herstellung von Gläsern und keramischen Glasuren eingesetzt.
- Herausforderungen:
- Die Abwässer enthalten oft schwer lösliche Metallverbindungen, die eine spezielle Behandlung erfordern.
Auswirkungen von Schwermetallen auf Umwelt und Gesundheit
Toxizität und Bioakkumulation
Schwermetalle sind nicht biologisch abbaubar und reichern sich in der Umwelt an. Bereits geringe Mengen können erhebliche Schäden in Ökosystemen verursachen:
- Chrom(VI): Hochgiftig und krebserregend; wird häufig in galvanischen Prozessen verwendet.
- Nickel: Reizend und allergen; eine häufige Kontamination in industriellen Abwässern.
- Quecksilber: Neurotoxisch und extrem persistent; bioakkumuliert in aquatischen Organismen.
- Cadmium: Führt zu Nieren- und Knochenschäden; häufig in Batterien und Pigmenten.
Auswirkungen auf technische Systeme
- Korrosion:
- Schwermetalle im Wasser begünstigen elektrochemische Korrosion in Rohrleitungen und Anlagen.
- Störungen biologischer Prozesse:
- Schwermetalle hemmen Mikroorganismen, die in biologischen Kläranlagen organische Stoffe abbauen, und stören damit die Reinigungsleistung.
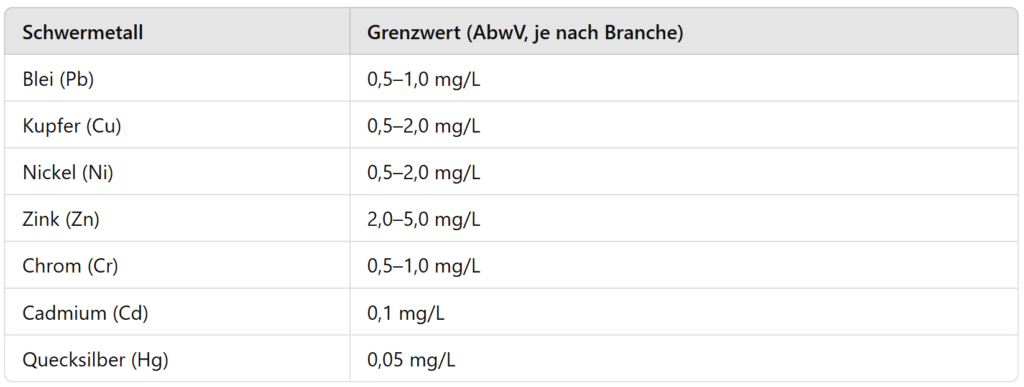
Grenzwerte für Schwermetalle in industriellen Abwässern
Die Einleitung von Schwermetallen in Gewässer oder öffentliche Abwassersysteme ist streng reguliert. Die Abwasserverordnung (AbwV) setzt branchenspezifische Grenzwerte, die eingehalten werden müssen, um Umweltbelastungen zu minimieren.
Verfahren zur Entfernung von Schwermetallen aus Wasser und Abwasser
Die Auswahl der Behandlungstechnologie hängt von der Konzentration, der Art des Schwermetalls und den Anforderungen an die Wasserqualität ab. Häufig werden CP-Anlagen mit Ionenaustauschern oder Aktivkohlefiltern kombiniert.
1. Fällung und Flockung in CP-Anlagen
Die chemische Fällung ist ein zentrales Verfahren in der Wasser- und Abwasserbehandlung zur Entfernung von Schwermetallen. Das Verfahren basiert auf der chemischen Umwandlung gelöster Schwermetallionen in schwer lösliche Verbindungen, die anschließend durch Sedimentation, Flotation oder Filtration aus dem Wasser entfernt werden können.
Mechanismus der Fällung
- Reaktion mit Hydroxidionen (Hydroxidfällung):
- Die Zugabe von Alkalien wie Kalkmilch (Ca(OH)₂) oder Natronlauge (NaOH) führt zur Erhöhung des pH-Werts, wodurch Schwermetallionen in Form von schwerlöslichen Metallhydroxiden ausgefällt werden.
- Dabei entstehen Metallhydroxidniederschläge, die durch ihre geringe Löslichkeit vom Wasser getrennt werden können.
- Reaktion mit Sulfiden (Sulfidfällung):
- Für Schwermetalle mit besonders geringer Löslichkeit als Sulfid (z. B. Quecksilber, Blei) werden Sulfidionen verwendet, typischerweise aus Natriumsulfid (Na₂S).
- Sulfide haben den Vorteil, dass sie auch bei leicht sauren pH-Werten stabile Niederschläge bilden.
- Fällung mit Komplexbildnern:
- In Fällen, in denen Schwermetalle in stabilen Komplexen vorliegen (z. B. durch Chelatbildner wie EDTA), können spezielle Reagenzien zur Aufspaltung der Komplexe notwendig sein, bevor die Fällung erfolgt.
Einflussfaktoren auf die Fällung
Die Effektivität der Fällung hängt von verschiedenen chemischen und physikalischen Faktoren ab, die sorgfältig kontrolliert werden müssen:
- pH-Wert:
- Der pH-Wert ist der wichtigste Parameter, da die Löslichkeit der meisten Schwermetallhydroxide stark vom pH-Wert abhängt.
- Beispiele:
- Zinkhydroxid fällt optimal bei pH 9–10 aus.
- Eisen(III)-hydroxid fällt bereits bei einem pH-Wert von 6–8 aus.
- Eine genaue Steuerung des pH-Werts ist notwendig, da bei zu hohen pH-Werten andere Metalle (z. B. Aluminium) wieder löslich werden können.
- Konzentration der Reagenzien:
- Eine ausreichende Menge des Fällungsmittels ist erforderlich, um alle Schwermetallionen zu binden. Eine Überdosierung kann jedoch zu erhöhten Betriebskosten und zusätzlichem Chemikalienverbrauch führen.
- Temperatur:
- Die Reaktionsgeschwindigkeit und die Löslichkeit der Fällungsprodukte sind temperaturabhängig. Höhere Temperaturen fördern in der Regel die Reaktionsgeschwindigkeit.
- Rührintensität und Kontaktzeit:
- Eine gute Durchmischung sorgt für einen intensiven Kontakt zwischen den Reagenzien und den Schwermetallionen.
- Die Kontaktzeit muss ausreichend lang sein, damit die chemischen Reaktionen vollständig ablaufen können.
- Interferenzen durch andere Ionen:
- Anionen wie Chlorid oder Sulfat können die Löslichkeit bestimmter Schwermetallverbindungen erhöhen und so die Effizienz der Fällung verringern.
- In solchen Fällen sind zusätzliche Fällungsreagenzien oder Vorbehandlungsschritte erforderlich.
Flockung: Stabilisierung und Abtrennung der Fällungsprodukte
Nach der Fällung bleiben die erzeugten Fällungsprodukte oft als feine Partikel im Wasser dispergiert. Die Flockung dient dazu, diese Partikel zu größeren Aggregaten (Flocken) zusammenzuführen, die sich leichter absetzen oder abscheiden lassen.
Mechanismus der Flockung
- Koagulation:
- Durch Zugabe von Koagulanten wie Eisen(III)- oder Aluminiumsalzen werden die elektrostatischen Abstoßungskräfte zwischen den Partikeln reduziert, was ihre Agglomeration erleichtert.
- Flockung:
- Flockungsmittel wie Polymere (z. B. Polyacrylamide) verstärken die Partikelbildung, indem sie die Flocken durch Brückenbildung miteinander verbinden.
Grenzen der Fällung und Flockung
- Komplexierte Schwermetalle:
- Schwermetalle, die in stabilen organischen oder anorganischen Komplexen vorliegen, können nur schwer ausgefällt werden. Eine vorherige Aufspaltung der Komplexe (z. B. durch Oxidation oder Reduktion) ist notwendig.
- Restkonzentrationen:
- Die chemische Fällung erreicht häufig nicht die extrem niedrigen Restkonzentrationen (< 0,01 mg/l) , die in manchen Industrien erforderlich sind. In solchen Fällen sind ergänzende Verfahren wie Adsorption oder Ionenaustausch erforderlich.
- Schlammproduktion:
- Die Fällung erzeugt große Mengen an Fällungsschlamm, der als Sonderabfall behandelt und entsorgt werden muss. Die Entsorgungskosten können erheblich sein.
- Chrom(VI):
- Schwermetalle wie Chrom(VI) müssen vor der Fällung in die weniger toxische Form Chrom(III) reduziert werden, beispielsweise durch Zugabe von Natriumbisulfit.
Foto: Unsere CP-Anlage ALMA CHEM MCW mit Fällung- und Flockung, Schlammentwässerung und nachgeschalteten Mehrschichtfilter und Ionenaustauscher (bei Bedarf)
2. Ionenaustausch
Der Ionenaustausch ist ein physikalisch-chemisches Verfahren, bei dem gelöste Ionen im Wasser durch Ionen in einem festen Ionenaustauscherharz ersetzt werden. Das Verfahren basiert auf der spezifischen Bindung von Kationen oder Anionen an aktive Gruppen in einem Harzmaterial. Durch die hohe Selektivität der Harze können Schwermetalle selbst aus stark verdünnten Lösungen entfernt werden.
Mechanismus des Ionenaustauschs
- Kationenaustausch:
- Schwermetallkationen wie Cu²⁺, Zn²⁺ oder Pb²⁺ werden durch H⁺-Ionen (hydrogene Harze) oder Na⁺-Ionen (natriumbasierte Harze) ersetzt.
- Das Schwermetallion wird an die Harzmatrix gebunden und aus dem Wasser entfernt.
- Anionenaustausch:
- Negativ geladene Schwermetallkomplexe, wie Chromate (CrO₄²⁻), werden durch OH⁻-Ionen ersetzt.
Arten von Ionenaustauschern
- Starke Kationenaustauscher:
- Effektiv bei der Entfernung von Schwermetallen wie Kupfer, Nickel und Zink aus sauren Lösungen.
- Einsatz bei pH-Werten von 1 bis 14 möglich.
- Schwache Kationenaustauscher:
- Wirksam bei mittleren bis hohen pH-Werten; ideal für leicht saure bis neutrale Lösungen.
- Starke Anionenaustauscher:
- Entfernen negativ geladene Komplexe wie Chromate oder Arsenate.
- Einsatz in alkalischen Lösungen.
- Selektive Harze:
- Entwickelt für spezifische Schwermetalle wie Quecksilber, Cadmium oder Chrom.
Einflussfaktoren auf den Ionenaustausch
- Ionenkonzentration:
- Der Ionenaustausch ist bei geringen Konzentrationen besonders effizient, da die Harze eine hohe Affinität zu Schwermetallionen haben.
- pH-Wert:
- Der pH-Wert beeinflusst die Ladung der Schwermetalle und somit ihre Bindung an das Harz. Beispielsweise liegt Eisen bei pH < 3 als Fe³⁺ vor und kann leicht entfernt werden, während es bei höheren pH-Werten zu Hydroxid fällt.
- Konkurrenzionen:
- Die Anwesenheit von anderen Kationen wie Ca²⁺ oder Mg²⁺ kann die Effektivität des Ionenaustausches verringern.
- Harzkapazität:
- Die maximale Beladung des Harzes wird durch dessen spezifische Kapazität (äquivalente Ionen pro Volumen) begrenzt.
- Regeneration:
- Nach Erreichen der Kapazitätsgrenze wird das Harz durch Chemikalien wie Salzsäure (HCl) oder Natronlauge (NaOH) regeneriert.
Vorteile und Grenzen des Ionenaustauschs
Vorteile:
- Sehr hohe Selektivität, auch für geringe Schwermetallkonzentrationen.
- Regenerierbar, wodurch Betriebskosten reduziert werden.
- Kann gezielt für spezifische Metalle (z. B. Chrom oder Kupfer) angepasst werden.
Grenzen:
- Begrenzte Kapazität bei hohen Konzentrationen.
- Konkurrenz durch andere Ionen kann die Effizienz verringern.
- Regenerationschemikalien erzeugen zusätzliche Abwässer.
Foto: Unsere Ionenaustauscheranlage ALMA ION mit vorgeschalteten Aktivkohlefilter ALMA FIL AK
3. Aktivkohleadsorption
Die Adsorption mittels Aktivkohlefiltern basiert auf der physikalischen oder chemischen Anlagerung von Schwermetallionen oder Schwermetallkomplexen an die Oberfläche eines porösen Materials wie Aktivkohle. Dabei wird die große innere Oberfläche der Aktivkohle genutzt, um die gelösten Stoffe aus dem Wasser zu binden.
Mechanismus der Adsorption
- Physikalische Adsorption:
- Schwermetalle werden durch Van-der-Waals-Kräfte oder elektrostatische Wechselwirkungen an der Oberfläche der Aktivkohle gehalten.
- Chemisorption:
- Schwermetalle bilden chemische Bindungen mit funktionellen Gruppen auf der Oberfläche der Aktivkohle (z. B. Carboxyl- oder Hydroxylgruppen).
Arten von Aktivkohle
- Pulveraktivkohle (PAK):
- Feines Pulver, das direkt ins Wasser gegeben wird.
- Besonders geeignet für Chargenbehandlungen.
- Granulataktivkohle (GAK):
- Grobkörnige Aktivkohle, die in Filtern eingesetzt wird.
- Langfristige und kontinuierliche Anwendung möglich.
- Imprägnierte Aktivkohle:
- Mit chemischen Reagenzien (z. B. Schwefel) behandelt, um spezifische Schwermetalle wie Quecksilber oder Arsen effizient zu entfernen.
Einflussfaktoren auf die Adsorption
- Konzentration der Schwermetalle:
- Höhere Konzentrationen führen zu einer besseren Auslastung der Adsorptionskapazität, aber auch zu einer schnelleren Sättigung.
- pH-Wert:
- Der pH-Wert beeinflusst die Ladung der Schwermetallionen und die Oberflächenladung der Aktivkohle.
- Beispiel:
- Bei niedrigem pH-Wert sind Schwermetalle wie Pb²⁺ positiv geladen und binden gut an die negativ geladene Aktivkohle.
- Temperatur:
- Adsorptionsprozesse sind meist exotherm, daher kann eine Erhöhung der Temperatur die Effizienz verringern.
- Porenstruktur:
- Die Größe und Verteilung der Poren in der Aktivkohle beeinflussen die Bindungskapazität.
Optimierung der Adsorption
- Vorbehandlung des Wassers:
- Entfernung von Schwebstoffen und organischen Verbindungen verbessert die Effektivität.
- Einsatz imprägnierter Aktivkohle:
- Für Schwermetalle wie Arsen und Quecksilber ist speziell behandelte Aktivkohle deutlich effektiver.
- Regeneration:
- Die Sättigung der Aktivkohle kann durch thermische oder chemische Verfahren rückgängig gemacht werden, wodurch die Betriebskosten gesenkt werden.
Vorteile und Grenzen der Aktivkohleadsorption
Vorteile:
- Hohe Effizienz bei geringen Schwermetallkonzentrationen.
- Vielseitig einsetzbar, auch für andere Schadstoffe wie organische Verbindungen.
- Kann gezielt für spezifische Schwermetalle imprägniert werden.
Grenzen:
- Begrenzte Kapazität der Adsorptionsmaterialien.
- Regeneration ist energie- und chemikalienintensiv.
- Weniger geeignet für hohe Schwermetallkonzentrationen.
Foto: Unsere Aktivkohlefilter ALMA FIL AK mit vorgeschalteten Mehrschichtfilter ALMA FIL
Fazit
Die Behandlung schwermetallbelasteter Abwässer aus industriellen Prozessen ist eine der zentralen Herausforderungen der Wasseraufbereitung. Die spezifischen Anforderungen an die Abwasserbehandlung variieren stark je nach Branche und Produktionsprozess. Mit fortschrittlichen Technologien wie Fällung und Flockung in CP-Anlagen, Ionenaustausch und Aktivkohleadsorption können die gesetzlichen Grenzwerte zuverlässig eingehalten und die Umweltauswirkungen minimiert werden.
Für weiter Informationen zu unseren Produkten können Sie uns gerne jederzeit kontaktieren!